Transformation chimique Bilan de la matière-exercices corrigés
 |
| Transformation chimique Bilan de la matière |
exercices corriges en Transformation chimique Bilan de la matière, programme physique chimie, tronc commun international Maroc.
I- La transformation chimique d’un système
1) Système chimique
a) Description d’un système chimique
Un système chimique est un ensemble d’espèces chimiques susceptibles de réagir entre elles, sur lesquelles porte une étude particulière.
Pour décrire un système chimique, il faut préciser :
- La nature et la quantité de matière des espèces chimiques présentes.
- L’état physique des espèces présentes : liquide (ℓ), solide (s), gazeux (g) ou en solution aqueuse (aq).
- La température T et la pression P du système.
b) Evolution du système
Les espèces chimiques constituant un système peuvent réagir entre elles. Le système chimique peut alors évoluer au corps du temps, de manière spontanée (sans intervention extérieure).
Lors de cette évolution, la composition du système chimique est modifiée. A l’echelle macroscopique, on observe par exemple un changement de couleur ou un dégagement gazeux. Des variations de température ou de pression peuvent également se produire.
2) La transformation chimique
a) Définition
Une transformation chimique est le passage d’un système chimique d’un état initial à un état final avec formation de nouvelles espèces chimiques.
- L’état initial d’un système chimique est l’état de ce système avant la transformation (avant que les espèces chimiques du système ne réagissent entre elles).
- L’état final d’un système chimique est l’état de ce système après la transformation (lorsque le système n’évolue plus).
b) Schématisation
On peut schématiser une transformation de la manière suivante :
c) Réactifs et produits
Lors d’une transformation chimique, certaines espèces chimiques sont consommées alors que d’autres se forment.
⇒ Réactifs : Ce sont les espèces chimiques présentes dans l’état initial et qui sont consommées partiellement ou totalement lors d’une transformation chimique.
Il peut éventuellement rester des réactifs en fin de transformation s’ils n’ont pas tous été consommés.
⇒ Produits : Ce sont les espèces chimiques formées lors d’une transformation chimique.
⇒ Spectateurs : Ce sont les espèces chimiques présentes dans l’état initial et qui ne participent pas la transformation chimique. On les retrouve donc intégralement à l’état final.
Exemple : dans la transformation mettant en jeu le métal cuivre et la solution de nitrate d’argent, les réactifs sont : les ions argent Ag+(aq) et le cuivre Cu(s).
Les produits sont des ions Cu2+(aq) et de l’argent Ag(s). Les ions nitrates ne participent pas à la réaction, ils sont spectateurs. La transformation peut être schématisée ainsi
2) La réaction chimique
Une réaction chimique modélise la transformation chimique subie par un système. Elle traduit le passage des réactifs aux produits. Son écriture symbolique s’appelle l’équation chimique :
- On utilise une flèche orientée de la gauche vers la droite.
- A gauche, on écrit les réactifs (symboles chimiques).
- A droite, on écrit les produits.
Seuls les réactifs et les produits figurent dans l’équation de la réaction. Les espèces chimiques spectatrices ne sont pas indiquées.
L’équation de la réaction traduit la concervation des élements chimiques et de la charge électrique entre les réactifs et les produits (somme des charges des ions réactifs = somme des charges des ions produits).
Pour cela, des nombres, appelés coefficients stoechiométriques, sont placés devant les formules chimiques des réactifs et des produits afin de respecter ces deux lois de conservation. Le coefficient stoechiométrique 1 n’est jamais écrit.
Exemples :
- L’équation de la réaction entre le cuivre Cu (s) et l’ion argent Ag+ (aq) s’écrit :
Cu (s) + 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag (s)
Les ions restent spectateurs. Ils n’apparaissent pas dans l’équation chimique.
- Equation de la combustion complète du méthane CH4 (g) dans le dioxygène O2 (g) de l’air :
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2O (g)
- Equation de la réaction entre le magnésium Mg (s) est les ions hydrogène H+(aq) d’une solution d’acide chlorhydrique (H+aq + Cl–aq) :
Mg (s) + 2 H+ (aq) → Mg2+ (aq) + H2 (g)
Les ions Cl–aq , spectateurs, n’apparaissent pas dans l’équation chimique.
II- Le bilan de la matière
1) L’avancement de la réaction
L’avancement d’une réaction, noté x, est une grandeur exprimée en mole qui permet de suivre l’évolution des quantités de matière des réactifs transformés et des produits formés au cours d’une réaction chimique.
Exemple :
Cu (s) + 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag (s)
Au cours de la réaction, les réactifs réagissant toujours dans les mêmes proportions, on peut écrire généralement :
1x mol de cuivre Cu (s) réagit avec 2x mol d’ions d’argent Ag+ (aq) pour former 1x mol d’ions cuivre Cu2+ (aq) et 2x mol d’argent Ag (s).
2) Le tableau d’avancement de la réaction
Le tableau d’avancement décrit l’évolution des quantités de matière d’un système chimique de l’état initial à l’état final, en fonction de l’avancement x de la réaction.
A l’état initial, l’avancement est nul (x = 0) et à l’état final l’avancement est maximal (noté xmax). Au cours de la transformation 0 < x < xmax.
Les quantités des réactifs diminuent alors que celles des produits augmentent. Elles n’évoluent plus lorsque l’état final atteint.
Soit la réaction chimique entre deux réactifs A et B, donnant comme produits C et D, où A, B, C, et D sont quatre espèces chimiques quelconques (avec a, b, c et d : coefficients stœchiométriques). On peut alors dresser le tableau d’avancement suivant :
3) Avancement maximal et le réactif limitant
a) Réactif limitant
Une transformation chimique s’arrète lorsqu’au moins un des réactifs est totalement consommé.
Le réactif limitant d’une transformation chimique est le réactif totalement consommé en premier.
La disparition totale du réactif limitant provoque l’arrét de la transformation. Si le ou les autres réactifs sont partiellement consommés, ils sont en excés.
b) Avancement maximal
L’avancement maximal xmax permet de connaître l’état final d’un système. Il correspond à la disparition du réactif limitant. L’avancement maximal est la plus petite valeur de x
pour laquelle la quantité de l’un des réactifs est nulle. Ce réactif est le réactif limitant.
pour laquelle la quantité de l’un des réactifs est nulle. Ce réactif est le réactif limitant.
c) Détermination de l’avancement maximal et du réactif limitant
Pour déterminer le réactif limitant dans le cas d’une réaction générale de type :
a A + b B → c C + d D
On pose deux hypothèses :
On compare alors les deux valeurs de xmax.
On choisit la plus petite valeur des deux pour xmax, et le réactif correspondant à cette valeur est dit réactif limitant.
Si les deux valeurs sont égales, alors A et B sont limitant : le mélange est dit stoechiomètrique.
Remarque :
Le savoir de l’avancement maximal xmax permet de déterminer les quantités de matière de tous les réactifs et produits dans l’état final, ce qui est appelé le bilan de la matière.
Exemple :
Considérons la réaction entre le cuivre Cu (s) et l’ion argent Ag+ (aq) d’équation :
Cu (s) + 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag (s)
√ Tableau d’avancement avec les quantités initiales des réactifs ni(Cu) = 0,3 mol et ni(Ag+) = 0,4 mol
√ Détermination de l’avancement maximal et du réactif limitant :
- Hypothèse 1: si Cu était le réactif limitant, alors 0,3 – xmax = 0 ; l’avancement maximal serait xmax = 0,3 mol.
- Hypothèse 2: si Ag+ était le réactif limitant, alors 0,4 – 2xmax = 0 ; l’avancement maximal serait xmax = 0,4/2 = 0,2 mol.
La plus petite des deux valeurs est la valeur de l’avancement maximal : xmax = 0,2 mol. Le réactif limitant est l’ion argent Ag+ (aq).
√ Bilan de la matière :
Le bilan de la matière pour cette réaction est la composition du mélange à l’état final.
4) Le mélange stœchiométrique (proportionnel)
Soit la réaction d’équation suivante :
a A + b B → c C + d D
Un mélange initial est dit stoechiométrique si les quantités initiales des réactifs sont dans les mêmes proportions que les coefficients stoechiométriques de l’équation de la réaction :
A la fin de la transformation chimique, les réactifs ont totalement disparu et l’état final n’est constitué que des produits de la réaction.
Exercice d’application :
Le glucose C6H12O6(s) réagit avec le dioxygène O2(g) en formant du dioxyde de carbone CO2(g) et de l’eau H2O(g).
- Ecrire et ajuster l’équation de la réaction.
- Dresser le tableau d’avancement de la réaction dans le cas où les quantités initiales des réactifs sont ni(C6H12O6) = 2mol et ni(O2) = 6mol.
- Déterminer le réactif limitant et l’avancement maximal de la réaction.
- Effectuer un bilan de matière à l’état final.





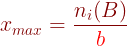



.jpg)









إرسال تعليق